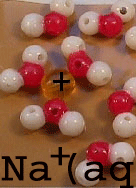 ........
........ .......
.......
was01 Perlenmodelle: Kleinste Teilchen von Salz in Lösungen und nach dem Auskristallisieren
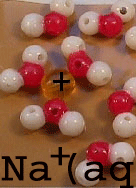 ........
........ .......
.......
Während des Lösens
von Stoffen in Wasser bilden Wasser-Moleküle Hüllen um die kleinsten
Teilchen dieser Stoffe.
Die Wasser-Moleküle
sind zwar elektrisch neutral, ihre Ladungen sind aber nicht gleichmäßig
verteilt:
Am O-Atom trägt
jedes Wassermolekül (H-O-H) eine Spur negativer Ladung, und
an den H-Atomen
gibt es ähnlich geringe positive Ladungen.
Diese Besonderheit
der Wasser-Moleküle macht sie anziehend für Ionen:
Ionen umhüllen
sich in Lösung (manchmal auch in Kristallen) mit Wasser-Molekülen
(Hydrathülle).
Die Anordnung der
Wasser-Moleküle um die Ionen von NaCl kannst Du durch Perlenmodelle
veranschaulichen:
* Links: Die
Na+-Ionen [gelbe Perlen] umhüllen sich so mit Wasser-Molekülen,
dass sie die leicht negativen O-Atome
dieser Moleküle [rote
Perlen] anziehen.
* Mitte: Die
(Cl-)-Ionen [grüne Perlen] umhüllen sich so
mit Wasser-Molekülen, dass sie die leicht positiven H-Atome
dieser Moleküle [weiße Perlen] anziehen.
* Rechts: Beim
Auskristallisieren verschwinden die Wasser-Moleküle von den Salz-Ionen,
die Na+ - und die Cl--Ionen ziehen sich
direkt an und bilden einen Kristall-Verband.